ਅਮੋਨੀਆ ਸਰੋਤ :
ਜੁਗਰਾਫ਼ੀਏ ਦਾ ਵਿਸ਼ਾ-ਕੋਸ਼, ਪਬਲੀਕੇਸ਼ਨ ਬਿਊਰੋ, ਪੰਜਾਬੀ ਯੂਨੀਵਰਸਿਟੀ, ਪਟਿਆਲਾ।
Ammonia (ਅਮਅਉਨਿਯਅ) ਅਮੋਨੀਆ: ਇਹ ਨਾਇਟਰੋਜਨ ਅਤੇ ਹਾਈਡਰੋਜਨ (nit-rogen and hydrogen) ਦਾ ਗੈਸਮਈ ਮਿਸ਼ਰਨ ਹੈ। ਇਹ ਪਾਣੀ ਵਿਚ ਘੁਲਣ ਕਰਕੇ ਖਾਰੇਪਣ (alkaline) ਦਾ ਮਿਸ਼ਰਨ ਬਣ ਜਾਂਦਾ ਹੈ ਅਤੇ ਉਦਯੋਗਾਂ ਵਿਚ ਪ੍ਰਯੋਗ ਕਰਕੇ ਖਾਦ (ammonium nitrate) ਤਿਆਰ ਕੀਤਾ ਜਾਂਦਾ ਹੈ।
ਲੇਖਕ : ਸ. ਸ. ਢਿੱਲੋਂ ਅਤੇ ਜ. ਪ. ਸਿੰਘ,
ਸਰੋਤ : ਜੁਗਰਾਫ਼ੀਏ ਦਾ ਵਿਸ਼ਾ-ਕੋਸ਼, ਪਬਲੀਕੇਸ਼ਨ ਬਿਊਰੋ, ਪੰਜਾਬੀ ਯੂਨੀਵਰਸਿਟੀ, ਪਟਿਆਲਾ।, ਹੁਣ ਤੱਕ ਵੇਖਿਆ ਗਿਆ : 1082, ਪੰਜਾਬੀ ਪੀਡੀਆ ਤੇ ਪ੍ਰਕਾਸ਼ਤ ਮਿਤੀ : 2014-01-29, ਹਵਾਲੇ/ਟਿੱਪਣੀਆਂ: no
ਅਮੋਨੀਆ ਸਰੋਤ :
ਪੰਜਾਬੀ ਯੂਨੀਵਰਸਿਟੀ ਪੰਜਾਬੀ ਕੋਸ਼ (ਸਕੂਲ ਪੱਧਰ), ਪਬਲੀਕੇਸ਼ਨ ਬਿਊਰੋ, ਪੰਜਾਬੀ ਯੂਨੀਵਰਸਿਟੀ, ਪਟਿਆਲਾ।
ਅਮੋਨੀਆ [ਨਾਂਪੁ] (ਵਿਗਿ) ਨਾਈਟਰੋਜਨ ਅਤੇ ਹਾਈਡਰੋਜਨ-ਯੋਗਿਕ, ਇਕ ਰੰਗਹੀਣ ਤਿੱਖੀ ਬੂਦਾਰ ਗੈਸ ਜੋ ਰਸਾਇਣਕ ਖਾਦਾਂ ਵਿਚ ਵਰਤੀ ਜਾਂਦੀ ਹੈ
ਲੇਖਕ : ਡਾ. ਜੋਗਾ ਸਿੰਘ (ਸੰਪ.),
ਸਰੋਤ : ਪੰਜਾਬੀ ਯੂਨੀਵਰਸਿਟੀ ਪੰਜਾਬੀ ਕੋਸ਼ (ਸਕੂਲ ਪੱਧਰ), ਪਬਲੀਕੇਸ਼ਨ ਬਿਊਰੋ, ਪੰਜਾਬੀ ਯੂਨੀਵਰਸਿਟੀ, ਪਟਿਆਲਾ।, ਹੁਣ ਤੱਕ ਵੇਖਿਆ ਗਿਆ : 1069, ਪੰਜਾਬੀ ਪੀਡੀਆ ਤੇ ਪ੍ਰਕਾਸ਼ਤ ਮਿਤੀ : 2014-02-24, ਹਵਾਲੇ/ਟਿੱਪਣੀਆਂ: no
ਅਮੋਨੀਆ ਸਰੋਤ :
ਪੰਜਾਬੀ ਵਿਸ਼ਵ ਕੋਸ਼–ਜਿਲਦ ਦੂਜੀ, ਭਾਸ਼ਾ ਵਿਭਾਗ ਪੰਜਾਬ
ਅਮੋਨੀਆ : ਇਹ ਇਕ ਰੰਗ-ਹੀਣ, ਤੇਜ਼ ਅਤੇ ਵਿਸ਼ੇਸ਼ ਗੰਧ ਵਾਲੀ ਹਵਾ ਤੋਂ ਹਲਕੀ ਗੈਸ ਹੈ। ਇਸ ਦੇ ਕੁਝ ਯੋਗਿਕਾਂ, ਜਿਵੇਂ ਕਿ ਅਮੋਨੀਅਮ ਕਲੋਰਾਈਡ (ਨੁਸ਼ਾਦਰ), ਦਾ ਬਹੁਤ ਪਹਿਲਾਂ ਤੋਂ ਪਤਾ ਸੀ ਪਰ ਅਮੋਨੀਆ ਗੈਸ ਦਾ ਪਤਾ ਸਭ ਤੋਂ ਪਹਿਲਾਂ ਪ੍ਰੀਸਟਲੇ ਦੁਆਰਾ 1774 ਈ. ਵਿਚ ਇਸ ਗੈਸ ਨੂੰ ਤਿਆਰ ਕਰਨ ਤੋਂ ਲੱਗਿਆ। ਸੀ. ਡਬਲਯੂ. ਸ਼ੀਲ ਨੇ 1777 ਈ. ਵਿਚ ਪਤਾ ਕੀਤਾ ਕਿ ਇਸ ਵਿਚ ਨਾਈਟ੍ਰੋਜਨ ਹੁੰਦੀ ਹੈ। ਫਿਰ 1785 ਵਿਚ ਸੀ. ਐੱਲ. ਬਰਥੋਲੇ ਨੇ ਇਸ ਗੈਸ ਦਾ ਬਿਜਲੀ ਦੀ ਚਿੰਗਾੜੀ ਦੁਆਰਾ ਵਿਯੋਜਨ ਕਰਕੇ ਦਰਸਾਇਆ ਕਿ ਇਸ ਵਿਚ ਹਾਈਡ੍ਰੋਜਨ ਤੇ ਨਾਈਟ੍ਰੋਜਨ ਤੱਤ ਹੁੰਦੇ ਹਨ।
ਅਮੋਨੀਆ ਗੈਸ ਦੀ ਥੋੜ੍ਹੀ ਜਿਹੀ ਮਾਤਰਾ ਹਵਾ ਅਤੇ ਮੀਂਹ ਦੇ ਪਾਣੀ ਵਿਚ ਮਿਲਦੀ ਹੈ। ਜੀਵਾਂ ਅਤੇ ਪੌਦਿਆਂ ਦੇ ਗਲਣ ਸੜਨ ਨਾਲ ਵੀ ਅਮੋਨੀਆਂ ਗੈਸ ਅਤੇ ਉਸ ਦੇ ਲੂਣ ਬਣਦੇ ਹਨ। ਇਸ ਦੇ ਕੁਝ ਯੋਗਿਕ ਖਣਿਜ, ਮਿੱਟੀ ਅਤੇ ਫ਼ਲਾਂ ਦੇ ਰਸ ਵਿਚ ਵੀ ਮਿਲਦੇ ਹਨ।
ਵਪਾਰਕ ਤੌਰ ਤੇ ਇਹ ਗੈਸ ਅਮੋਨੀਆਮਈ ਲਿਕਰ ਜਾਂ ਹਵਾਂ ਤੋਂ ਤਿਆਰ ਕੀਤੀ ਜਾਂਦੀ ਹੈ।
1.ਅਮੋਨੀਆਮਈ ਲਿਕਰ ਤੋਂ – ਕੋਲੇ ਵਿਚ ਪੁਰਾਣੀਆਂ ਬਨਸਪਤੀਆਂ ਦੀ 1.5 ਪ੍ਰਤੀਸ਼ਤ ਖੈ ਨਾਈਟ੍ਰੋਜਨ ਹੁੰਦੀ ਹੈ ਅਤੇ ਜਦੋਂ ਕੋਲੇ ਦਾ ਕਾਰਬਨੀਕਰਨ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ਤਾਂ ਕੋਲ ਗੈਸ ਦੇ ਨਾਲ ਹੀ ਯੋਗਿਕਾਂ ਦੇ ਰੂਪ ਵਿਚ ਅਮੋਨੀਆ ਲੰਘ ਜਾਂਦੀ ਹੈ ਅਤੇ ਅਮੋਨੀਆਮਈ ਲਿਕਰ ਵਿਚ ਆ ਜਾਂਦੀ ਹੈ। ਜਦੋਂ ਇਸ ਲਿਕਰ ਨੂੰ ਭਾਫ਼ ਦੀ ਧਾਰਾ ਵਿਚ ਚੂਨੇ ਨਾਲ ਗਰਮ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ਤਾਂ ਕੁਝ ਅਮੋਨੀਅਮ ਲੂਣ ਸਿਰਫ਼ ਤਾਪ ਦੇ ਅਸਰ ਨਾਲ ਹੀ ਅਪਘਟਿਤ ਹੋ ਜਾਂਦੇ ਹਨ ਅਤੇ ਬਾਕੀਆਂ ਦਾ ਅਪਘਟਨ ਚੂਨੇ ਦੇ ਅਸਰ ਨਾਲ ਹੋ ਜਾਂਦਾ ਹੈ ਜਿਸ ਦੇ ਸਿੱਟੇ ਵਜੋਂ ਅਮੋਨੀਆ ਗੈਸ ਪ੍ਰਾਪਤ ਹੁੰਦੀ ਹੈ।
2. ਹਵਾ ਤੋਂ – ਹਵਾ ਵਿਚਲੀ ਨਾਈਟ੍ਰੋਜਨ ਨੂੰ ਅਮੋਨੀਆ ਵਿਚ ਬਦਲਣ ਲਈ ਹਾਬਰ ਵਿਧੀ ਅਤੇ ਸਾਇਐਨੇਮਾਈਡ ਵਿਧੀ ਵਰਤੀ ਜਾਂਦੀ ਹੈ।
(ਉ) ਹਾਬਰ ਵਿਧੀ – ਇਹ ਵਿਧੀ ਨਾਈਟ੍ਰੋਜਨ ਅਤੇ ਹਾਈਡ੍ਰੋਜਨ ਦੇ ਸਿੱਧੇ ਮੇਲ ਉੱਤੇ ਆਧਾਰਿਤ ਹੈ :-
N2 + 3H2 – 2NH3 + 24,000 ਕੈਲੋਰੀਆਂ
ਇਹ ਕਿਰਿਆ ਪਰਤਵੀ ਅਤੇ ਤਾਪ-ਨਿਕਾਸੀ ਹੈ। ਨਿਮਨ ਤਾਪਮਾਨ ਕਾਇਮ ਕਰਕੇ ਅਤੇ ਉੱਚ ਦਬਾਉ ਪਾ ਕੇ ਅਮੋਨੀਆ ਦੀ ਚੋਖੀ ਮਾਤਰਾ ਪ੍ਰਾਪਤ ਕੀਤੀ ਜਾ ਸਕਦੀ ਹੈ। ਅਮਲੀ ਰੂਪ ਵਿਚ ਨਾਈਟ੍ਰੋਜਨ ਦੇ ਇਕ ਭਾਗ ਅਤੇ ਹਾਈਡ੍ਰੋਜਨ ਦੇ ਤਿੰਨ ਭਾਗਾਂ ਨੂੰ 200 ਵਾਯੂਮੰਡਲ ਦਬਾਉ ਤੇ 500˚ ਸੈਂ. ਤੋਂ 700˚ ਸੈਂ. ਉੱਤੇ ਉਤਪ੍ਰੇਰਕ ਉੱਤੋਂ ਲੰਘਾਇਆ ਜਾਂਦਾ ਹੈ। ਇਸ ਤਰ੍ਹਾਂ ਵੀ ਕੇਵਲ 10 ਪ੍ਰਤੀਸ਼ਤ ਪਰਿਵਰਤਨ ਹੀ ਹੁੰਦਾ ਹੈ। ਇਸ ਮੰਤਵ ਲਈ ਵਰਤਿਆ ਜਾਂਦਾ ਉਤਪ੍ਰੇਰਕ ਹੇਠ ਲਿਖਿਆਂ ਵਿਚੋਂ ਕੋਈ ਇਕ ਹੁੰਦਾ ਹੈ :-
ਮਾੱਲਿਬਡਿਨਮ ਜਾਂ ਕੈਲਸ਼ੀਅਮ ਮਿਲਿਆ ਆਇਰਨ ਚੂਰਨ, ਸਿਲੀਕਾ ਅਤੇ ਪੋਟਾਸ਼ੀਅਮ ਆਕਸਾਈਡ ਮਿਲਿਆ ਫ਼ੈਰਿਕ, ਆਕਸਾਇਡ, ਆਸਮੀਅਮ ਜਾਂ ਯੂਰੇਨੀਅਮ ਚੂਰਨ ਜਾਂ ਪਿਊਮਿਸ ਸਟੋਨ ਤੇ ਜੰਮਾਇਆ ਨਿਕਲ ਚੂਰਨ।
(ਅ) ਸਾਈਐਨੇਮਾਈਡ ਵਿਧੀ-ਇਸ ਵਿਧੀ ਵਿਚ 800˚ ਸੈਂ. ਤੇ ਗਰਮ ਕੀਤੇ ਕੈਲਸ਼ੀਅਮ ਕਾਰਬਾਈਡ ਉਪਰ ਹਵਾ ਲੰਘਾਈ ਜਾਂਦੀ ਹੈ ਜਿਸ ਨਾਲ ਕੈਲਸ਼ੀਅਮ ਸਾਇਐਨੇਮਾਈਡ ਬਣਦਾ ਹੈ :-
-CaC2+N2→Ca3N2+C
ਇਸ ਕੈਲਸ਼ੀਅਮ ਸਾਇਐਨੇਮਾਈਡ ਨੂੰ ਦਬਾਓ ਹੇਠ ਭਾਫ਼ ਨਾਲ ਮਿਲਾਉਣ ਤੇ ਅਮੋਨੀਆ ਗੈਸ ਪ੍ਰਾਪਤ ਹੁੰਦੀ ਹੈ:-
CaCN2+3H2O→CaCO3+2NH3
ਪ੍ਰਯੋਗਸ਼ਾਲਾ ਵਿਚ ਅਮੋਨੀਆ ਗੈਸ ਬਣਾਉਣ ਦੇ ਪ੍ਰਸਿੱਧ ਢੰਗ ਇਹ ਹਨ :-
1. ਖਾਰੇ ਹਾਈਡ੍ਰਾੱਕਸਾਈਡਾਂ ਦੀ ਅਮੋਨੀਅਮ ਲੂਣਾਂ ਨਾਲ ਕਿਰਿਆ ਦੁਆਰਾ :-
NH4CL+NaOH Ӓ NaCL + NH3 +H2Oਅਤੇ
2. ਨਾਈਟ੍ਰਾਈਡਾਂ ਦੇ ਹਾਈਡ੍ਰਾਲਿਸਿਜ਼ ਦੁਆਰਾ :-
Mg3N2+6H2O→3Mg(OH)2+2NH3
ਅਮੋਨੀਆ ਗੈਸ ਹਵਾ ਤੋਂ ਹਲਕੀ ਹੈ। ਇਸ ਦੇ ਕੁਝ ਵਿਸ਼ੇਸ਼ ਭੌਤਿਕ ਗੁਣ ਹੇਠਾਂ ਸਾਰਨੀ ਵਿਚ ਦਿੱਤੇ ਗਏ ਹਨ :-
ਪਿਘਲਾਉ ਦਰਜਾ 195.36k(-77.74˚ਸੈਂ.)
ਉਬਾਲ ਦਰਜਾ 239.68 ਸੈਂ..K (-33.4˚ਸੈਂ.)
ਕ੍ਰਾਂਤਿਕ ਤਾਪਮਾਨ 406.0 K (132.9ਸੈਂ.)
ਉਬਾਲ ਦਰਜੇ ਉੱਤੇ ਵਿਸ਼ਿਸ਼ਟ ਤਾਪ 1.07 ਕੈਲੋਰੀ/ਗ੍ਰਾ.
ਜਮਾਉ ਦਰਜੇ ਉੱਤੇ ਵਿਸ਼ਿਸ਼ਟ ਤਾਪ 1.05 ਕੈਲੋਰੀ/ਗ੍ਰਾ.
ਗਲਣ ਤਾਪ 1352 ਕੈਲੋਰੀ/ਮੋਲ
ਵਾਸ਼ਪੀਕਰਨ ਤਾਪ (ਉਬਾਲ ਦਰਜੇ ਤੇ) 5581 ਕੈਲੋਰੀ/ਮੋਲ
ਠੋਸ ਦੀ ਤੀਹਰੇ ਬਿੰਦੂ ਉੱਤੇ ਘਣਤਾ 0.735 ਗ੍ਰਾ/ਮਿ.ਲੀ.3
ਠੋਸ ਦੀ ਉਬਾਲ ਦਰਜੇ ਉੱਤੇ ਘਣਤਾ 0.682 ਗ੍ਰਾ/ਮਿ.ਲਿ3
ਠੋਸ ਦੀ ਕ੍ਰਾਂਤਿਕ ਤਾਪਮਾਨ ਉੱਤੇ ਘਣਤਾ 0.234 ਗ੍ਰਾ/ਮਿ.ਲਿ.3
ਤੀਹਰੇ ਬਿੰਦੂ ਉੱਤੇ ਵਾਸ਼ਪ ਦਬਾਉ 45.58 ਮਿ.ਮੀ. (ਪਾਰੇ ਦੇ)
-40 ਸੈਂ. ਉੱਤੇ ਵਾਸ਼ਪ ਦਬਾਉ 583.3 ਮਿ.ਮੀ. (ਪਾਰੇ ਦੇ)
0 ਸੈਂ. ਉੱਤੇ ਵਾਸ਼ਪ ਦਬਾੳ 3221.0 ਮਿ.ਮੀ. (ਪਾਰੇ ਦੇ)
30 ਸੈਂ. ਉੱਤੇ ਵਾਸ਼ਪ ਦਬਾੳ 8749.0 ਮਿ.ਮੀ. (ਪਾਰੇ ਦੇ)
ਕ੍ਰਾਂਤਿਕ ਤਾਪਮਾਨ ਉੱਤੇ ਵਾਸ਼ਪ ਦਬਾਉ 112.3 ਵਾਯੂਮੰਡਲ
ਪਾਣੀ ਵਿਚ ਘੁਲਣਸ਼ੀਲਤਾ (1 ਵਾਯੂਮੰਡਲ
ਤੇ 20˚ ਸੈਂ. ਤੇ) 33.1% (ਭਾਰ ਅਨੁਸਾਰ)
ਲੇਸਲਾਪਣ (ਤਰਲ, 25˚ ਸੈਂ.) 0.00 1350 ਪਾਇਜ਼
ਇਹ ਗਿਆਤ ਕੀਤਾ ਗਿਆ ਹੈ ਕਿ ਅਮੋਨੀਆ ਦਾ ਅਣੂੰ ਪਿਰਾਮਿਡੀ ਬਣਤਰ ਵਾਲਾ ਹੈ :-
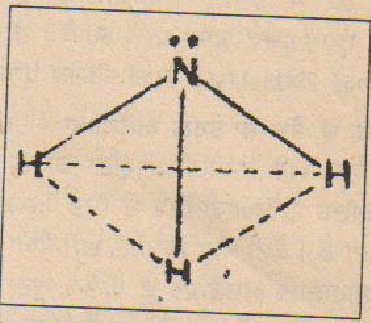
ਇਹ ਪਿਰਾਮਿਡੀ ਅਣੂੰ ਆਸਾਨੀ ਨਾਲ ਹੀ ਉਲਟ ਜਾਂਦਾ ਹੈ। ਇਹ ਵੇਖਿਆ ਗਿਅ ਹੈ ਕਿ ਇਹ ਅਣੂੰ 23,870 ਮੈਗਾ ਸਾਈਕਲ ਦੀ ਆਵ੍ਰਿਤੀ ਨਾਲ ਦੋ ਅੰਤਮ ਰੂਪਾਂ ਵਿਚਕਾਰ ਡੋਲਦਾ ਰਹਿੰਦਾ ਹੈ। ਇਸ ਦਾ ਇਹ ਗੁਣ ਅਮੋਨੀਆ ਕਲਾਕ ਬਣਾਉਣ ਵਿਚ ਵਰਤਿਆ ਗਿਆ ਹੈ ਜੋ ਕਿ ਸਮਾਂ ਮਿਣਨ ਦਾ ਸਭ ਤੋਂ ਵਧੀਆ ਅਤੇ ਠੀਕ ਯੰਤਰ ਹੈ।
ਅਮੋਨੀਆ (ਅਤੇ ਇਸ ਦੇ ਵਿਉਤਪਤਾਂ) ਦੇ ਬਹੁਤ ਸਾਰੇ ਗੁਣਾਂ ਨੂੰ ਸਮਝਣ ਲਈ ਇਹ ਬਣਤਰ ਬਹੁਤ ਸਹਾਈ ਹੁੰਦੀ ਹੈ ਜਿਵੇਂ ਕਿ ਇਸ ਦੀ ਪ੍ਰੋਟਾਨ ਪ੍ਰਾਪਤ ਕਰਕੇ ਅਮੋਨੀਅਮ ਆਇਨ (NH4+) ਬਣਨ ਦੀ ਚੇਸ਼ਟਾ :-
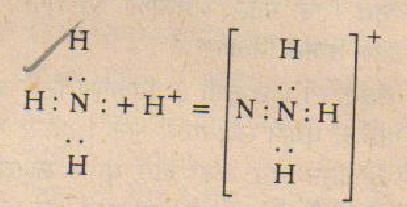
ਅਤੇ ਇਸ ਦੀ ਉਪ ਸਹਿ-ਸੰਯੋਜਕ ਯੋਗਿਕ ਬਣਾਉਣ ਦੀ ਚੇਸ਼ਟਾ, ਜਿਹਾ ਕਿ ਧਾਤਵੀ ਐਮੀਨ ਜਿਨ੍ਹਾਂ ਨੂੰ ਅਮੋਨੀਏਟ ਵੀ ਕਹਿੰਦੇ ਹਨ। ਇਨ੍ਹਾਂ ਯੋਗਿਕਾਂ ਦੇ ਅਣੂੰਆਂ ਵਿਚ ਕ੍ਰਿਸਟਲੀਕਰਨ-ਅਮੋਨੀਆਂ ਹੁੰਦਾ ਹੈ। ਇਨ੍ਹਾਂ ਯੋਗਿਕਾਂ ਦੀ ਸਥਿਰਤਾ ਵਿਚ ਕਾਫ਼ੀ ਅੰਤਰ ਹੁੰਦਾ ਹੈ ਜਿਵੇ AgCL.3NH3 ਵਿਚੋਂ ਤਾਂ ਅਮੋਨੀਆ ਸਹਿਜੇ ਹੀ ਨਿਕਲ ਜਾਂਦੀ ਹੈ ਪਰ [Co(NH3)6] CL3 ਅਤੇ [Cr(NH3)6] (NO3)3 ਬਹੁਤ ਸਥਾਈ ਹੁੰਦੇ ਹਨ। ਅਮੋਨੀਆ ਜਲਣ ਵਿਚ ਸਹਾਇਤਾ ਨਹੀਂ ਦਿੰਦੀ ਪ੍ਰੰਤੂ ਆਕਸੀਜਨ ਦੀ ਹੋਂਦ ਵਿਚ ਇਸ ਦੇ ਜਲਣ ਨਾਲ ਕਈ ਪਦਾਰਥ ਬਣਦੇ ਹਨ ਜਿਨ੍ਹਾਂ ਵਿਚ ਮੁੱਖ ਤੌਰ ਤੇ ਨਾਈਟ੍ਰੋਜਨ, ਪਾਣੀ ਅਤੇ ਨਾਈਟ੍ਰੋਜਨ ਦੇ ਕੁਝ ਆਕਸਾਈਡ ਹੁੰਦੇ ਹਨ। ਅਮੋਨੀਆ ਦੀ ਪਲੈਟਿਨਮ ਜਾਲੀ ਵਰਗੇ ਉਤਪ੍ਰੇਰਕ ਦੀ ਹੋਂਦ ਵਿਚ, ਹਵਾ ਦੁਆਰਾ ਸੀਮਿਤ ਆਕਸੀਕਰਨ ਦੀ ਤਕਨੀਕੀ ਵਿਧੀ ਵਿਚ ਮਹੱਤਤਾ ਵਾਲੀ ਹੈ। ਇਸ ਦੁਆਰਾ ਨਾਈਟ੍ਰੋਜਨ ਆਕਸਾਈਡ ਬਣਦਾ ਹੈ ਜਿਹੜਾ ਕਿ ਓਸਟਵਾਲਟ ਵਿਧੀ ਰਾਹੀਂ ਨਾਈਟ੍ਰਿਕ ਐਸਿਡ ਬਣਾਉਣ ਲਈ ਮੁਢਲਾ ਪਦਾਰਥ ਹੈ। ਕਲੋਰੀਨ ਨਾਲ ਅਮੋਨੀਆ (ਵਧੇਰੇ ਮਾਤਰਾ ਵਿਚ) ਦੀ ਕਿਰਿਆ ਦੁਆਰਾ ਅਮੋਨੀਅਮ ਕਲੋਰਾਈਡ ਅਤੇ ਨਾਈਟ੍ਰੋਜਨ ਜਾਂ ਕਲੋਰਐਮੀਨ (NH2C1) ਬਣਦੇ ਹਨ। ਜੇ ਕਲੋਰੀਨ ਵਧੇਰੇ ਮਾਤਰਾ ਵਿਚ ਵਰਤੀ ਜਾਵੇ ਤਾਂ ਅਤਿ-ਵਿਸਫ਼ੋਟਕ ਨਾਈਟ੍ਰੋਜਨ ਟ੍ਰਾਈਕਲੋਰਾਈਡ NCl3 ਬਣਦਾ ਹੈ। ਆਇਓਡੀਨ ਨਾਲ ਮਿਲ ਕੇ ਇਹ ਗੈਸ ਬਹੁਤ ਸ਼ਕਤੀਸ਼ਾਲੀ ਵਿਸਫੋਟਕ, ਨਾਈਟ੍ਰੋਜਨ ਟ੍ਰਾਈਆਇਓਡਾਈਡ (NI3NH3) ਬਣਾਉਦੀ ਹੈ।
ਅਮੋਨੀਆ ਪਾਣੀ ਵਿਚ ਬਹੁਤ ਹੀ ਘੁਲਣਸ਼ੀਲ ਹੈ (ਅਮੋਨੀਆ ਦੇ 700 ਭਾਗ, 20˚ ਸੈਂ. ਤੇ ਇਕ ਵਾਯੂਮੰਡਲ ਦਬਾਉ ਤੇ ਇਕ ਭਾਗ ਪਾਣੀ ਵਿਚ)। ਬਹੁਤ ਨੀਵੇਂ ਤਾਪਮਾਨ (-80 ਸੈਂ.) ਤੇ ਅਮੋਨੀਆ ਤੋਂ NH3H2O ਅਤੇ 2NH3H2O ਵਰਗੇ ਯੋਗਿਕ ਪ੍ਰਾਪਤ ਹੁੰਦੇ ਹਨ।
ਘੋਲਕ ਦੇ ਤੌਰ ਤੇ ਸਰਲ ਅਮੋਨੀਆ – ਤਰਲ ਅਮੋਨੀਆ ਦੇ ਅਨੋਖੇ ਭੌਤਿਕ ਅਤੇ ਰਸਾਇਣਿਕ ਗੁਣਾਂ ਕਾਰਨ ਇਸ ਨੂੰ ਕਈ ਵਿਸ਼ੇਸ਼ ਰਸਾਇਣਿਕ ਕਿਰਿਆਵਾਂ ਵਿਚ ਉੱਚਿਤ ਘੋਲਕ ਦੇ ਤੌਰ ਤੇ ਵੀ ਵਰਤਿਆ ਜਾਂਦਾ ਹੈ। ਕਈ ਪੱਖਾਂ ਤੋਂ ਤਰਲ ਅਮੋਨੀਆ ਦੇ ਘੋਲਕ ਗੁਣ ਪਾਣੀ ਅਤੇ ਈਥਾਈਲ ਅਲਕੋਹਲ ਦੇ ਘੋਲਕ ਗੁਣਾਂ ਦੇ ਮੱਧਵਰਤੀ ਹਨ। ਇਹ ਗੱਲ ਸਥਿਰ-ਅੰਕ ਦੇ ਪੱਖੋਂ ਤਾਂ ਬਿਲਕੁਲ ਠੀਕ ਹੈ। ਇਸ ਲਈ ਆਇਨੀ ਪਦਾਰਥਾਂ ਨੂੰ ਘੋਲਣ ਲਈ ਈਥਾਈਲ ਅਲਕੋਹਲ ਨਾਲੋਂ ਅਮੋਨੀਆ ਵਧੇਰੇ ਚੰਗੀ ਹੈ ਪਰ ਪਾਣੀ ਨਾਲੋਂ ਨਹੀਂ। ਦੂਸਰੇ ਪਾਸੇ ਸਾਹਿਸੰਯੋਜਕ (covalent) ਪਦਾਰਥਾਂ ਲਈ ਪਾਣੀ ਨਾਲੋਂ ਅਮੋਨੀਆ ਚੰਗਾ ਘੋਲਕ ਹੈ। ਪਾਣੀ ਅਤੇ ਤਰਲ ਅਮੋਨੀਆ ਦੋਹਾਂ ਵਿਚ ਹੀ ਸਵੈ-ਆਇਨੀਕਰਨ ਤਾਂ ਹੁੰਦਾ ਹੈ ਪਰ ਤਰਲ ਅਮੋਨੀਆ ਵਿਚ ਇਹ ਘੱਟ ਹੁੰਦਾ ਹੈ।
2NH3 ↔ N H4++ NH2-
[NH4+] [NH2-] = 1.9×10-33, -50˚ ਸੈਂ. ਤੇ।
ਘੋਲਕ ਦੇ ਰੂਪ ਵਿਚ ਤਰਲ ਅਮੋਨੀਆ ਦੀ ਪਾਣੀ ਨਾਲੋਂ ਉਪਯੋਗਤਾ ਇਨ੍ਹਾਂ ਗੱਲਾਂ ਕਾਰਨ ਜ਼ਿਆਦਾ ਹੈ :-
1. ਪ੍ਰੋਟਾਨ ਛੱਡਣ ਦੀ ਘੱਟ ਰੁਚੀ 2. ਜ਼ਿਆਦਾ ਇਲੈੱਕਟ੍ਰਾੱਨ ਦੇਣ ਵੱਲ ਝੁਕਾਉ ਅਤੇ 3. ਪ੍ਰਬਲ ਲਘੂਕਾਰਕ ਗੁਣ। ਪਹਿਲੇ ਅੰਤਰ ਕਾਰਨ, ਅਮੋਨੀਆ ਨੂੰ ਬਹੁਤ ਤੇਜ਼ ਖਾਰਾਂ ਅਤੇ ਪ੍ਰਬਲ ਲਘੂਕਾਰਕਾਂ ਲਈ ਘੋਲਕ ਦੇ ਤੌਰ ਤੇ ਵਰਤਿਆ ਜਾਂਦਾ ਹੈ ਪਰ ਦੂਸਰੇ ਅੰਤਰ ਕਾਰਨ ਤਰਲ ਅਮੋਨੀਆ ਦੇ ਘੋਲ ਬਹੁਤ ਤੇਜ਼ ਤੇਜ਼ਾਬ ਨਹੀਂ ਬਣਾਉਂਦੇ ਕਿਉਂਕਿ ਤੇਜ਼ ਤੇਜ਼ਾਬ ਉਸੇ ਵੇਲੇ ਹੀ ਅਮੋਨੀਆ ਆਇਨ ਵਿਚ ਬਦਲ ਜਾਂਦੇ ਹਨ ਜਿਹੜਾ ਕਿ ਜਲੀ ਸਿਸਟਮਾਂ ਵਿਚਲੇ ਬਰਾਬਰ ਦੇ ਹਾਈਡ੍ਰੋਨੀਅਮ ਆਇਨ ਨਾਲੋਂ ਬਹੁਤ ਦੁਰਬਲ ਤੇਜ਼ਾਬ ਹੈ। ਇਸ ਲਈ ਇਹ ਆਖਿਆ ਜਾ ਸਕਦਾ ਹੈ ਕਿ ਰਸਾਇਣਿਕ ਕਿਰਿਆਵਾਂ ਲਈ ਘੋਲਕ ਦੇ ਰੂਪ ਵਿਚ ਪਾਣੀ ਨਾਲੋਂ ਤਰਲ ਅਮੋਨੀਆ ਤੋਂ ਵਧੇਰੇ ਤੇਜ਼ ਖਾਰ ਅਤੇ ਵਧੇਰੇ ਪ੍ਰਬਲ ਲਘੂਕਾਰਕ ਪ੍ਰਾਪਤ ਹੁੰਦੇ ਹਨ ਪਰ ਇਸ ਤੋਂ ਪ੍ਰਾਪਤ ਹੁੰਦੇ ਤੇਜ਼ਾਬ ਅਤੇ ਆਕਸੀਕਾਰਕ ਦੁਰਬਲ ਹੁੰਦੇ ਹਨ।
ਲੇਖਕ : ਭਾਸ਼ਾ ਵਿਭਾਗ,
ਸਰੋਤ : ਪੰਜਾਬੀ ਵਿਸ਼ਵ ਕੋਸ਼–ਜਿਲਦ ਦੂਜੀ, ਭਾਸ਼ਾ ਵਿਭਾਗ ਪੰਜਾਬ, ਹੁਣ ਤੱਕ ਵੇਖਿਆ ਗਿਆ : 933, ਪੰਜਾਬੀ ਪੀਡੀਆ ਤੇ ਪ੍ਰਕਾਸ਼ਤ ਮਿਤੀ : 2015-07-20, ਹਵਾਲੇ/ਟਿੱਪਣੀਆਂ: no
ਅਮੋਨੀਆ ਸਰੋਤ :
ਪੰਜਾਬੀ ਕੋਸ਼ ਜਿਲਦ ਪਹਿਲੀ (ੳ ਤੋਂ ਕ)
ਅਮੋਨੀਆ, ਅੰਗਰੇਜ਼ੀ / ਪੁਲਿੰਗ : ਇਕ ਗੈਸ, ਇਕ ਦਵਾਈ
ਲੇਖਕ : ਭਾਸ਼ਾ ਵਿਭਾਗ, ਪੰਜਾਬ,
ਸਰੋਤ : ਪੰਜਾਬੀ ਕੋਸ਼ ਜਿਲਦ ਪਹਿਲੀ (ੳ ਤੋਂ ਕ), ਹੁਣ ਤੱਕ ਵੇਖਿਆ ਗਿਆ : 255, ਪੰਜਾਬੀ ਪੀਡੀਆ ਤੇ ਪ੍ਰਕਾਸ਼ਤ ਮਿਤੀ : 2021-10-07-04-40-50, ਹਵਾਲੇ/ਟਿੱਪਣੀਆਂ:
ਵਿਚਾਰ / ਸੁਝਾਅ
Please Login First