ਸੰਯੋਜਕਤਾ ਸਰੋਤ :
ਜੁਗਰਾਫ਼ੀਏ ਦਾ ਵਿਸ਼ਾ-ਕੋਸ਼, ਪਬਲੀਕੇਸ਼ਨ ਬਿਊਰੋ, ਪੰਜਾਬੀ ਯੂਨੀਵਰਸਿਟੀ, ਪਟਿਆਲਾ।
Connectivity (ਕਅਨੈਕਟਿਵਟਿ) ਸੰਯੋਜਕਤਾ: ਇਹ ਇਕ ਸੰਖਿਅਕੀ ਸ਼ਬਦ ਹੈ, ਜੋ ਮਾਰਗਾਂ ਦੇ ਜਾਲ (network) ਵਿੱਚ ਮਾਰਗ ਸਿਰਿਆਂ (nodes) ਦੇ ਅੰਤਰ ਜੋੜਾਂ (links) ਦੇ ਦਰਜੇ ਨੂੰ ਦਰਸਾਉਂਦਾ ਹੈ। ਜੋੜਾਂ ਦੀ ਉੱਚ ਗਿਣਤੀ ਤੋਂ ਭਾਵ ਸੰਯੋਜਕਤਾ (connecti-vity) ਦਾ ਉੱਚ ਦਰਜਾ ਹੈ।
ਲੇਖਕ : ਸ. ਸ. ਢਿੱਲੋਂ ਅਤੇ ਜ. ਪ. ਸਿੰਘ,
ਸਰੋਤ : ਜੁਗਰਾਫ਼ੀਏ ਦਾ ਵਿਸ਼ਾ-ਕੋਸ਼, ਪਬਲੀਕੇਸ਼ਨ ਬਿਊਰੋ, ਪੰਜਾਬੀ ਯੂਨੀਵਰਸਿਟੀ, ਪਟਿਆਲਾ।, ਹੁਣ ਤੱਕ ਵੇਖਿਆ ਗਿਆ : 2720, ਪੰਜਾਬੀ ਪੀਡੀਆ ਤੇ ਪ੍ਰਕਾਸ਼ਤ ਮਿਤੀ : 2014-01-29, ਹਵਾਲੇ/ਟਿੱਪਣੀਆਂ: no
ਸੰਯੋਜਕਤਾ ਸਰੋਤ :
ਪੰਜਾਬੀ ਯੂਨੀਵਰਸਿਟੀ ਪੰਜਾਬੀ ਕੋਸ਼ (ਸਕੂਲ ਪੱਧਰ), ਪਬਲੀਕੇਸ਼ਨ ਬਿਊਰੋ, ਪੰਜਾਬੀ ਯੂਨੀਵਰਸਿਟੀ, ਪਟਿਆਲਾ।
ਸੰਯੋਜਕਤਾ [ਨਾਂਇ] ਇੱਕ ਪਰਮਾਣੂ ਦੀ ਕਿਸੇ ਹੋਰ ਪਰਮਾਣੂ ਨਾਲ਼ ਬੰਧਨ ਬਣਾਉਣ ਸਮੇਂ ਦਿੱਤੇ ਲਏ ਜਾਂ ਸਾਂਝੇ ਕੀਤੇ ਇਲੈੱਕਟਰਾਨਾਂ ਦੀ ਸੰਖਿਆ; ਕਿਸੇ ਤੱਤ ਦੀ ਸੰਯੋਜਨ ਸਮਰੱਥਾ
ਲੇਖਕ : ਡਾ. ਜੋਗਾ ਸਿੰਘ (ਸੰਪ.),
ਸਰੋਤ : ਪੰਜਾਬੀ ਯੂਨੀਵਰਸਿਟੀ ਪੰਜਾਬੀ ਕੋਸ਼ (ਸਕੂਲ ਪੱਧਰ), ਪਬਲੀਕੇਸ਼ਨ ਬਿਊਰੋ, ਪੰਜਾਬੀ ਯੂਨੀਵਰਸਿਟੀ, ਪਟਿਆਲਾ।, ਹੁਣ ਤੱਕ ਵੇਖਿਆ ਗਿਆ : 2720, ਪੰਜਾਬੀ ਪੀਡੀਆ ਤੇ ਪ੍ਰਕਾਸ਼ਤ ਮਿਤੀ : 2014-02-24, ਹਵਾਲੇ/ਟਿੱਪਣੀਆਂ: no
ਸੰਯੋਜਕਤਾ ਸਰੋਤ :
ਪੰਜਾਬੀ ਵਿਸ਼ਵ ਕੋਸ਼–ਜਿਲਦ ਚੌਥੀ, ਭਾਸ਼ਾ ਵਿਭਾਗ ਪੰਜਾਬ
ਸੰਯੋਜਕਤਾ (Valence or Valency) : ਰਸਾਇਣ-ਵਿਗਿਆਨ ਵਿਚ, ਤੱਤਾਂ ਦੀ ਸੰਯੋਜਨ ਸ਼ਕਤੀ ਨੂੰ ਸੰਯੋਜਕਤਾ ਕਹਿੰਦੇ ਹਨ। ਫਰੈਂਕਲੈਂਡ ਨੇ ਸਪੱਸ਼ਟ ਕੀਤਾ ਕਿ ਅਕਾਰਬਨੀ ਯੋਗਿਕਾਂ ਵਿਚ ਅਕਸਰ ਇਕ ਕੇਂਦਰੀ ਤੱਤ ਬਾਕੀ ਤੱਤਾਂ ਦੇ ਨਿਸ਼ਚਿਤ ਤੁਲ-ਅੰਕਾਂ ਨਾਲ ਸੰਯੋਗ ਕਰਦਾ ਹੈ ਉਦਾਹਰਨ ਵਜੋਂ ਨਾਈਟ੍ਰੋਜਨ, ਫ਼ਾੱਸਫ਼ੋਰਸ ਅਤੇ ਆਰਸਨਿਕ ਦਾ ਇਕ ਪ੍ਰਮਾਣੂ ਹਾਈਡ੍ਰੋਜਨ ਤੇ ਕਲੋਰੀਨ ਦੇ ਤਿੰਨ ਜਾਂ ਪੰਜ ਪ੍ਰਮਾਣੂਆਂ ਦੇ ਸੰਯੋਗ ਕਰਕੇ ਯੋਗਿਕ ਬਣਾਉਂਦਾ ਹੈ। ਜੇ ਹਾਈਡ੍ਰੋਜਨ ਦੀ ਸੰਯੋਜਕਤਾ ਨੂੰ ਇਕਾਈ ਮੰਨ ਲਿਆ ਜਾਵੇ ਤਾਂ ਕਿਸੇ ਤੱਤ ਦੀ ਸੰਯੋਜਕਤਾ ਹਾਈਡ੍ਰੋਜਨ ਪ੍ਰਮਾਣੂਆਂ ਦੀ ਉਨ੍ਹਾਂ ਸੰਖਿਆਵਾਂ ਦੇ ਬਰਾਬਰ ਹੋਵੇਗੀ ਜਿਨ੍ਹਾਂ ਨਾਲ ਉਸ ਤੋਂ ਤੱਤ ਦਾ ਪ੍ਰਮਾਣੂ ਸੰਯੋਗ ਕਰ ਸਕਦਾ ਹੈ, ਜਿਵੇਂ ਕਲੋਰੀਨ, ਆਕਸੀਜਨ, ਹਾਈਟ੍ਰੋਜਨ ਤੇ ਕਾਰਬਨ ਦਾ ਇਕ ਪ੍ਰਮਾਣੂ ਹਾਈਡ੍ਰੋਜਨ ਤੇ ਤਰਤੀਬਵਾਰ ਇਕ ਦੋ, ਤਿੰਨ ਤੇ ਚਾਰ ਪਰਮਾਣੂਆਂ ਨਾਲ ਸੰਯੋਗ ਕਰਦਾ ਹੈ। ਇਸੇ ਲਈ ਇਨ੍ਹਾਂ ਦੀਆਂ ਸੰਯੋਜਕਤਾਵਾਂ ਤਰਤੀਬਵਾਰ ਇਕ, ਦੋ, ਤਿੰਨ ਤੇ ਚਾਰ ਹਨ। ਜੋ ਤੱਤ ਹਾਈਡ੍ਰੋਜਨ ਨਾਲ ਸੰਯੋਗ ਨਹੀਂ ਕਰਦੇ, ਉਨ੍ਹਾਂ ਦੀ ਸੰਯੋਜਕਤਾ, ਕਲੋਰੀਨ ਜਾਂ ਆਕਸੀਜਨ ਦੀ ਸੰਯੋਜਕਤਾ ਨੂੰ ਤਰਤੀਬਵਾਰ ਇਕ ਜਾਂ ਦੋ ਮੰਨ ਕੇ ਪਤਾ ਕੀਤੀ ਜਾ ਸਕਦੀ ਹੈ ਜਿਵੇਂ ਥੋਰੀਅਮ ਦਾ ਇਕ ਪ੍ਰਮਾਣੂ ਕਲੋਰੀਨ ਦੇ ਚਾਰ ਤੇ ਆਕਸੀਜਨ ਦੇ ਦੋ ਪ੍ਰਮਾਣੂਆਂ ਨਾਲ ਸੰਯੋਗ ਕਰਦਾ ਹੈ ਤਾਂ ਇਸ ਦੀ ਸੰਯੋਜਕਤਾ ਚਾਰ ਹੈ।
ਆਮ ਕਰਕੇ ਤੱਤਾਂ ਦੀ ਸੰਯੋਜਕਤਾ ਨੂੰ ਰੇਖਾਵਾਂ ਦਆਰਾ ਦਿਖਾਇਆ ਜਾਂਦਾ ਹੈ। ਇਨ੍ਹਾਂ ਰੇਖਾਵਾਂ ਨੂੰ ਸੰਯੋਜਕਤਾ ਬੰਧਨ (valency bonds) ਕਹਿੰਦੇ ਹਨ। ਇਨ੍ਹਾਂ ਬੰਧਨਾਂ ਦਾ ਪ੍ਰਯੋਗ ਕਰਦੇ ਹੋਏ ਕੁਝ ਸਰਲ ਯੋਗਿਕਾਂ ਦੇ ਫ਼ਾਰਮੂਲੇ ਅੱਗੇ ਦਿੱਤੇ ਗਏ ਹਨ :––
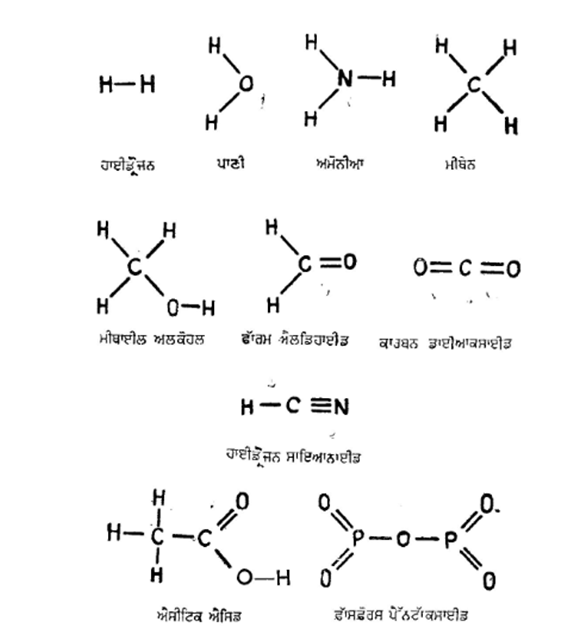
ਪ੍ਰਸਿੱਧ ਆਰਗੈਨਿਕ-ਵਿਗਿਆਨੀ ਕੈਕੁਲੇ ਦੇ ਵਿਚਾਰ ਵੀ ਫਰੈਂਕਲੈਂਡ ਨਾਲ ਮਿਲਦੇ ਜੁਲਦੇ ਸਨ, ਪ੍ਰੰਤੂ ਇਕ ਗੱਲ ਦਾ ਹੀ ਮੱਤ-ਭੇਦ ਸੀ ਕਿ ਅਕਾਰਬਨੀ ਯੋਗਿਕਾਂ ਵਿਚ ਜ਼ਿਆਦਾਤਰ ਇਕ ਹੀ ਤੱਤ ਦੀ ਸੰਯੋਜਕਤਾ ਭਿੰਨ ਭਿੰਨ ਯੋਗਿਕਾਂ ਵਿਚ ਵੱਖਰੀ ਹੋ ਸਕਦੀ ਹੈ ਜਿਵੇਂ PCl3 ਅਤੇ PCl5 ਯੋਗਿਕਾਂ ਵਿਚ ਫ਼ਾੱਸਫ਼ੋਰਸ ਦੀ ਸੰਯੋਜਕਤਾ ਤਰਤੀਬਵਾਰ ਤਿੰਨ ਤੇ ਪੰਜ ਹੈ। ਇਸ ਦੇ ਉਲਟ ਕਾਰਬਨੀ ਯੋਗਿਕਾਂ ਵਿਚ ਜੋ ਜ਼ਿਆਦਾਤਰ ਕਾਰਬਨ, ਹਾਈਡ੍ਰੋਜਨ, ਆਕਸੀਜਨ ਤੇ ਨਾਈਟ੍ਰੋਜਨ ਦੇ ਸੰਯੋਗ ਨਾਲ ਬਣੇ ਹੁੰਦੇ ਹਨ, ਇਨ੍ਹਾਂ ਤੱਤਾਂ ਦੀ ਸੰਯੋਜਕਤਾ ਸਥਿਰ ਅਤੇ ਸਭ ਕਾਰਬਨੀ ਯੋਗਿਕਾਂ ਵਿਚ ਤਰਤੀਬਵਾਰ ਚਾਰ, ਇਕ, ਦੋ ਤੇ ਤਿੰਨ ਹੁੰਦੀ ਹੈ।
ਸੰਯੋਜਕਤਾ ਪਤਾ ਲਗ ਜਾਣ ਨਾਲ ਪ੍ਰਮਾਣੂ-ਭਾਰ ਕੱਢਣ ਲਈ ਬੜੀ ਸਹਾਇਤਾ ਮਿਲੀ ਹੈ। ਕਿਸੇ ਵੀ ਤੱਤ ਦਾ ਪ੍ਰਮਾਣੂ-ਭਾਰ ਉਸ ਦੇ ਤੁਲ-ਅੰਕੀ ਭਾਰ (equivalent weight) ਅਤੇ ਸੰਯੋਜਕਤਾ ਦੇ ਗੁਣਨਫਲ ਦੇ ਬਰਾਬਰ ਹੁੰਦਾ ਹੈ। ਤੱਤਾਂ ਦੇ ਤੁਲ-ਅੰਕੀ ਭਾਰ ਪ੍ਰਯੋਗਾਂ ਦੁਆਰਾ ਬੜੀ ਅਸਾਨੀ ਨਾਲ ਕਢੇ ਜਾ ਸਕਦੇ ਹਨ। ਉਨ੍ਹੀਵੀਂ ਸਦੀ ਦੇ ਚੌਥੇ ਭਾਗ ਵਿਚ ਜਦੋਂ ਰੂਸੀ ਵਿਗਿਆਨੀ ਮੈਂਡਲੀਫ਼ ਨੇ ਆਵਰਤੀ ਸਾਰਨੀ (periodic table) ਦਾ ਵਰਣਨ ਕੀਤਾ ਤਾਂ ਨਾਲ ਹੀ ਉਸ ਸਾਰਨੀ ਵਿਚ ਕਿਸੇ ਤੱਤ ਦੀ ਸਥਿਤੀ ਅਤੇ ਉਸ ਦੀ ਸੰਯੋਜਕਤਾ ਦਾ ਸੰਬੰਧ ਵੀ ਸਪੱਸ਼ਟ ਕੀਤਾ। ਤੱਤਾਂ ਨੂੰ ਉਨ੍ਹਾਂ ਦੇ ਪਰਮਾਣੂ-ਭਾਰ ਦੇ ਕ੍ਰਮ ਅਨੁਸਾਰ ਰਖਣ ਤੇ ਹਰੇਕ ਤੱਤ ਆਪਣੇ ਤੋਂ ਅੱਠਵੇਂ ਤੱਤ ਨਾਲ ਭੌਤਿਕ ਅਤੇ ਰਸਾਇਣਿਕ ਗੁਣਾਂ ਵਿਚ ਸਮਾਨਤਾ ਦਰਸਾਉਂਦਾ ਹੈ। ਇਸ ਤਰ੍ਹਾਂ ਅਕ੍ਰਿਆਸ਼ੀਲ ਗੈਸਾਂ ਦੇ ਅਵਿਸ਼ਕਾਰ ਤੋਂ ਬਾਅਦ ਵਰਤਮਾਨ ਆਵਰਤੀ-ਸਾਰਨੀ ਨੌਂ ਗਰੁੱਪਾਂ ਵਿਚ ਵੰਡੀ ਜਾਂਦੀ ਹੈ। ਇਨ੍ਹਾਂ ਵਿਚ ਅਕ੍ਰਿਆਸ਼ੀਲ ਗੈਸਾਂ ਜਿਵੇਂ ਹੀਲੀਅਮ, ਨੀਆੱਨ, ਆਰਗਾਨ, ਕ੍ਰਿਪਟਾੱਨ, ਜ਼ੀਨਾਨ ਅਤੇ ਰੇਡਾੱਨ ਦਾ ਗਰੁਪ ਜ਼ੀਰੋ ਗਰੁੱਪ ਕਹਾਉਂਦਾ ਹੈ, ਕਿਉਂਕਿ ਇਹ ਤੱਤ ਕਿਸੇ ਭੀ ਹੋਰ ਤੱਤ ਵੱਲ ਸੰਯੋਜਨ ਸ਼ਕਤੀ ਨਹੀਂ ਦਰਸਾਉਂਦੇ। ਅਗਲਾ ਗਰੁੱਪ ਐਲੱਕਲੀ ਜਾਂ ਖਾਰ ਧਾਤਾਂ (ਜਿਵੇਂ ਲਿਥੀਅਮ, ਸੋਡੀਅਮਲ ਤੇ ਪੋਟਾਸ਼ੀਅਮ ਆਦਿ) ਦਾ ਪਹਿਲਾ ਗਰੁੱਪ ਹੈ ਅਤੇ ਇਨ੍ਹਾਂ ਸਾਰਿਆਂ ਦੀ ਸੰਯੋਜਕਤਾ ਵੀ ਹਾਈਡ੍ਰੋਜਨ, ਕਲੋਰੀਨ ਤੇ ਆਕਸੀਜਨ ਸਭ ਵੱਲ ਇਕ ਹੁੰਦੀ ਹੈ। ਇਸੇ ਤਰ੍ਹਾਂ ਦੂਸਰੇ (ਮੈਗਨੀਸ਼ੀਅਮ, ਕੈਲਸੀਅਮ ਆਦਿ), ਤੀਸਰੇ (ਬੋਰਾਨ, ਐਲੂਮਿਨੀਅਮ ਆਦਿ) ਅਤੇ ਚੌਥੇ (ਕਾਰਬਨ, ਸਿਲਿਕਾੱਨ ਆਦਿ) ਗਰੁੱਪ ਦੇ ਤੱਤਾਂ ਦੀ ਸੰਯੋਜਕਤਾ ਤਰਤੀਬਵਾਰ ਦੋ, ਤਿੰਨ ਤੇ ਚਾਰ ਹੈ। ਪੰਜਵੇਂ (ਨਾਈਟ੍ਰੋਜਨ, ਫ਼ਾੱਸਫ਼ੋਰਸ ਆਦਿ), ਛੇਵੇਂ (ਗੰਧਕ, ਕ੍ਰੋਮੀਅਮ ਆਦਿ) ਅਤੇ ਸੱਤਵੇਂ (ਫਲੋਰੀਨ, ਕਲੋਰੀਨ, ਬ੍ਰੋਮੀਨ ਆਦਿ) ਗਰੁੱਪਾਂ ਦੇ ਤੱਤ ਆਕਸੀਜਨ ਦੇ ਪ੍ਰਤਿ ਤਾਂ ਤਰਤੀਬਵਾਰ ਪੰਜ, ਛੇ ਅਤੇ ਸੱਤ ਸੰਯੋਜਕਤਾ ਦਰਸਾਉਂਦੇ ਹਨ, ਪ੍ਰੰਤੂ ਹਾਈਡ੍ਰੋਜਨ ਤੇ ਕਲੋਰੀਨ ਦੇ ਪ੍ਰਤਿ ਇਨ੍ਹਾਂ ਗਰੁੱਪਾਂ ਦੇ ਤੱਤਾਂ ਦੀ ਸੰਯੋਜਕਤਾ ਤਰਤੀਬਵਾਰ ਤਿੰਨ, ਦੋ ਅਤੇ ਇਕ ਹੈ।
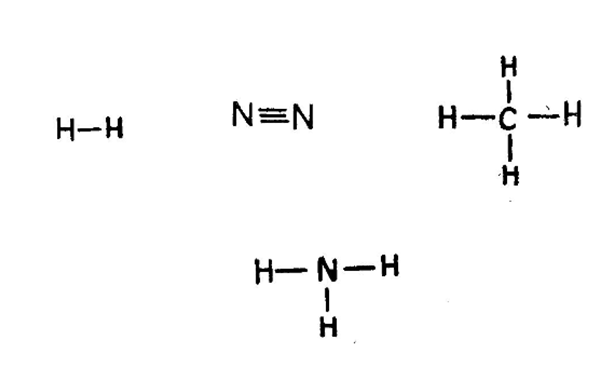
ਵੀਂਹਵੀ ਸਦੀ ਦੇ ਸ਼ੁਰੂ ਵਿਚ ਸਰ ਜੇ. ਜੇ. ਟਾੱਮਸਨ ਅਤੇ ਨੀਲ ਬੋਰ ਨੇ ਪ੍ਰਯੋਗਾਂ ਅਤੇ ਆਪਣੀ ਕਲਪਨਾ ਨਾਲ ਪ੍ਰਮਾਣੂਆਂ ਦੀ ਰਚਨਾ ਬਾਰੇ ਸਾਡੇ ਗਿਆਨ ਵਿਚ ਵਾਧਾ ਕੀਤਾ ਤੇ ਰਦਰਫੋਰਡ ਨੇ ਪ੍ਰਮਾਣੂਆਂ ਦੇ ਨਿਊਕਲੀ ਰੂਪ ਬਾਰੇ ਦੱਸਿਆ। ਇਸ ਦੇ ਅਨੁਸਾਰ ਹਰ ਪ੍ਰਮਾਣੂ ਦੇ ਕੇਂਦਰ ਵਿਚ ਚਾਰਜਿਤ ਭਾਰੀ ਨਿਊਕਲੀਅਸ ਹੁੰਦਾ ਹੈ ਜਿਸ ਦੁਆਰਾ ਇਲੈੱਕਟ੍ਰਾੱਨ ਵਖ ਵਖ ਆਰਬਿਟਾਂ ਵਿਚ ਚੱਕਰ ਲਗਾਉਂਦੇ ਹਨ। ਅਖੀਰਲੇ ਆਰਬਿਟ ਦੇ ਇਲੈੱਕਟ੍ਰਾੱਨਾਂ ਨੂੰ ‘ਸੰਯੋਜਨ ਇਲੈੱਕਟ੍ਰਾੱਨ ਕਿਹਾ ਜਾਂਦਾ ਹੈ, ਕਿਉਂਕਿ ਸੰਯੋਜਕਤਾ ਦੇ ਇਲੈੱਕਟ੍ਰਾੱਨ ਸਿੱਧਾਂਤ ਅਨੁਸਾਰ ਇਹੀ ਇਲੈੱਕਟ੍ਰਾੱਨ ਤੱਤ ਦੀ ਸੰਯੋਜਤ ਸ਼ਕਤੀ ਮਿਥਦੇ ਹਨ। ਸੰਯੋਜਕਤਾ ਤਿੰਨ ਤਰ੍ਹਾਂ ਦੀ ਹੁੰਦੀ ਹੈ ਜਿਵੇਂ ਸੋਡੀਅਮ ਦਾ ਪ੍ਰਮਾਣੂ ਇਕ ਇਲੈਕਟ੍ਰਾੱਨ ਖੋ ਕੇ ਅਤੇ ਫਲੋਰੀਨ ਦਾ ਪ੍ਰਮਾਣੂ ਇਕ ਇਲੈਕਟ੍ਰਾੱਨ ਲੈ ਕੇ ਸੋਡੀਅਮ ਫਲੋਰਾਈਡ ਬਣਾਉਂਦੇ ਹਨ ਤੇ ਇਸ ਕਿਰਿਆ ਵਿਚ ਸੋਡੀਅਮ (Na+) ਤੇ ਫਲੋਰਾਈਡ ਦੋਵੇਂ ਆਇਨ ਅਕ੍ਰਿਆਸ਼ੀਲ ਗੈਸ ਨੀਆੱਨ ਦੀ ਇਲੈੱਕਟ੍ਰਾੱਨ ਤਰਤੀਬ ਪ੍ਰਾਪਤ ਕਰ ਲੈਂਦੇ ਹਨ। ਇਸ ਪ੍ਰਕਾਰ ਦੀ ਸੰਯੋਜਕਤਾ ਨੂੰ ਬਿਜਲੱਈ ਸੰਯੋਜਕਤਾ (electro-valency) ਕਹਿੰਦੇ ਹਨ। ਇਸ ਤਰ੍ਹਾਂ ਬਣੇ ਯੋਗਿਕਾਂ ਦਾ ਪਿਘਲਾਉ-ਦਰਜਾ ਅਤੇ ਉਬਾਲ-ਦਰਜਾ ਉੱਚਾ ਹੁੰਦਾ ਹੈ। ਇਸ ਸੰਯੋਜਕਤਾ ਬਾਰੇ ਕਾੱਸੇਲ ਨੇ 1916 ਈ. ਵਿਚ ਦੱਸਿਆ ਸੀ। ਇਸੇ ਸਾਲ ਹੀ ਅਮਰੀਕਨ ਰਸਾਇਣ-ਵਿਗਿਆਨੀ ਲੂਇਸ (Lewis) ਨੇ ਦੱਸਿਆ ਕਿ ਕੁਝ ਤੱਤ ਇਕ ਹੋਰ ਤਰੀਕੇ ਨਾਲ ਵੀ ਅਕ੍ਰਿਆਸ਼ੀਲ ਗੈਸਾਂ ਦੀ ਇਲੈੱਕਟ੍ਰਾੱਨ ਤਰਤੀਬ ਪ੍ਰਾਪਤ ਕਰ ਸਕਦੇ ਹਨ। ਇਸ ਅਨੁਸਾਰ ਸੰਯੋਗ ਕਰਨ ਵਾਲੇ ਦੋ ਪ੍ਰਮਾਣੂ ਕਦੇ ਆਪਣ ਇਕ, ਦੋ ਜਾਂ ਤਿੰਨ ਇਲੈੱਕਟ੍ਰਾੱਨਾਂ ਨੂੰ ਸਾਂਝਾ ਕਰਕੇ ਦੋਵੇਂ ਹੀ ਅਕ੍ਰਿਆਸ਼ੀਲ ਗੈਸਾਂ ਦੀ ਤਰਤੀਬ ਪ੍ਰਾਪਤ ਕਰ ਲੈਂਦੇ ਹਨ। ਇਸ ਪ੍ਰਕਾਰ ਦੀ ਸੰਯੋਜਕਤਾ ਨੂੰ ਸਹਿਸੰਯੋਜਕਤਾ ਕਹਿੰਦੇ ਹਨ। ਇਸ ਦੀਆਂ ਉਦਾਹਰਨਾਂ ਇਹ ਹਨ :––
ਤੀਸਰੀ ਕਿਸਮ ਦੀ ਸੰਯੋਜਕਤਾ ਨੂੰ ਉਪ-ਸਹਿਸੰਯੋਜਕਤਾ ਕਿਹਾ ਜਾਂਦਾ ਹੈ। ਇਸ ਵਿਚ ਵਖਰਾਪਣ ਇਹੀ ਹੈ ਕਿ ਬੰਧਨ ਬਣਾਉਣ ਵਿਚ ਭਾਗ ਲੈਣ ਵਾਲੇ ਦੋਵੇਂ ਇਲੈੱਕਟ੍ਰਾੱਨ, ਆਪਸ ਵਿਚ ਜੁੜੇ ਦੋ ਪ੍ਰਮਾਣੂਆਂ ਵਿਚੋਂ ਇਕ ਦੁਆਰਾ ਦਿੱਤੇ ਜਾਂਦੇ ਹਨ। ਉਦਾਹਰਨ ਵਜੋਂ ਜਿਵੇ ਅਮੋਨੀਆ, ਬੋਰਾਨ ਟ੍ਰਾਈਫਲੋਰਾਈਡ ਨਾਲ ਇਕ ਅਣਵੀ ਯੋਗਿਕ ਬਣਾਉਣ ਲਈ ਮਿਲਦੀ ਹੈ। ਇਹ ਨਾਈਟ੍ਰੋਜਨ ਪ੍ਰਮਾਣੂ ਦਾ ਇਕੱਲਾ ਇਲੈੱਕਟ੍ਰਾੱਨ ਯੁਗਮ (lone-pair) ਹੀ ਹੁੰਦਾ ਹੈ ਜਿਹੜਾ ਕਿ ਨਵਾਂ ਬੰਧਨ ਬਣਾਉਣ ਵਿਚ ਹਿੱਸਾ ਲੈਂਦਾ ਹੈ। ਬੋਰਾਨ ਟ੍ਰਾਈਫਲੋਰਾਈਡ ਵਿਚ ਬੋਰਾਨ ਦੇ ਸੰਯੋਜਕ ਸ਼ੈੱਲ ਵਿਚ ਸਿਰਫ਼ ਛੇ ਇਲੈੱਕਟ੍ਰਾੱਨ ਹੁੰਦੇ ਹਨ, ਇਸ ਲਈ ਇਹ ਆਪਣੇ ਅਸ਼ਟਕ (octet) ਨੂੰ ਪੂਰਾ ਕਰਨ ਲਈ ਦੋ ਇਲੈੱਕਟ੍ਰਾੱਨ ਹੋਰ ਸਮਾ ਸਕਦਾ ਹੈ। ਇਸ ਤਰ੍ਹਾਂ ਜੇ ਨਾਈਟ੍ਰੋਜਨ ਪ੍ਰਮਾਣੂ ਆਪਣੇ ਇਕੱਲੇ ਇਲੈੱਕਟ੍ਰਾੱਨ ਯੁਗਮ ਦਾ ਪ੍ਰਯੋਗ ਕਰੇ ਤਾਂ ਅਮੋਨੀਆ ਅਤੇ ਬੋਰਾਨ ਟ੍ਰਾਈਫਲੋਰਾਈਡ ਦੇ ਮੇਲ ਨੂੰ ਇਸ ਤਰ੍ਹਾਂ ਦਰਸਾਇਆ ਜਾ ਸਕਦਾ ਹੈ :––
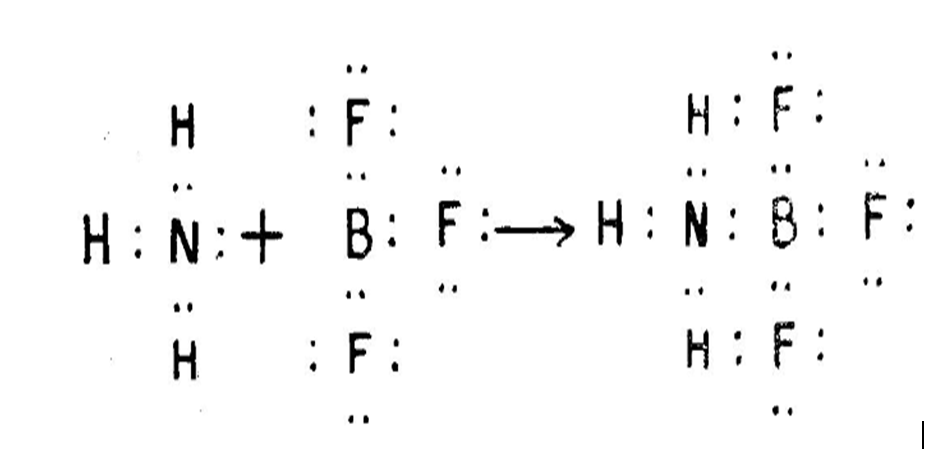
ਪ੍ਰਚਲਤ ਪ੍ਰਮਾਣਵੀ ਰਚਨਾ ਫ਼ਾਰਮੂਲੇ ਅਨੁਸਾਰ ਇਕ ਉਪ-ਸਹਿਸੰਯੋਜਕ ਬੰਧਨ ਨੂੰ ਤੀਰ ਦੇ ਨਿਸ਼ਾਨ ਨਾਲ ਵਿਖਾਇਆ ਜਾਂਦਾ ਹੈ ਜਿਵੇਂ :––
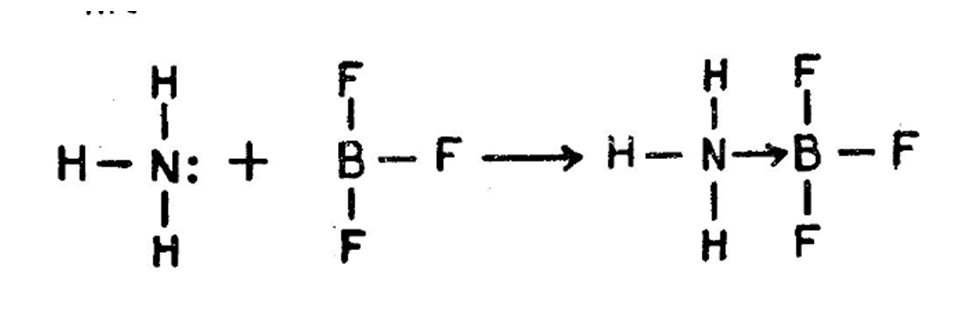
ਜਿਹੜਾ ਪ੍ਰਮਾਣੂ, ਇਕੱਲਾ ਇਲੈੱਟ੍ਰਾੱਨ ਯੁਗਮ ਸਪਲਾਈ ਕਰਦਾ ਹੈ ਉਸ ਨੂੰ ਦਾਤਾ ਪ੍ਰਮਾਣੂ (donor atom) ਅਤੇ ਜੋ ਇਸ ਨੂੰ ਪ੍ਰਾਪਤ ਕਰਦਾ ਹੈ ਉਸ ਨੂੰ ਸਵੀਕਾਰੀ ਪ੍ਰਮਾਣੂ ਕਿਹਾ ਜਾਂਦਾ ਹੈ। ਕਿਉਂ ਜੋ ਇਕ ਪ੍ਰਮਾਣੂ ਹੀ ਇਕੱਲਾ ਇਲੈੱਕਟ੍ਰਾੱਨ-ਯੁਗਮ ਸਪਲਾਈ ਕਰਦਾ ਹੈ ਇਸ ਲਈ ਉਪ-ਸਹਿੰਸਯੋਜਕ ਬੰਧਨ ਨੂੰ ਦਾਤਾ-ਬੰਧਨ (donor-link) ਵੀ ਕਿਹਾ ਜਾਂਦਾ ਹੈ।
ਸੰਯੋਗ ਤੋਂ ਪਹਿਲਾਂ ਦੋਵੇਂ ਦਾਤਾ ਅਤੇ ਸਵੀਕਾਰੀ ਪ੍ਰਮਾਣੂ ਬਿਜਲੱਈ ਤੌਰ ਤੇ ਉਦਾਸੀਨ ਹੁੰਦੇ ਹਨ ਪ੍ਰੰਤੂ ਸੰਯੋਗ ਤੋਂ ਮਗਰੋਂ ਦਾਤਾ ਪ੍ਰਮਾਣੂ ਇਕੱਲੇ ਇਲੈੱਕਟ੍ਰਾਨ ਯੁਗਮ ਵਿਚ ਇਕ ਹਿੱਸਾ ਦੇ ਦਿੰਦਾ ਹੈ ਅਤੇ ਸਵੀਕਾਰੀ ਪ੍ਰਮਾਣੂ ਇੱਕ ਹਿੱਸਾ ਲੈ ਲੈਂਦਾ ਹੈ। ਇਸ ਤਰ੍ਹਾਂ ਦਾਤਾ ਪ੍ਰਮਾਣੂ ਤੇ ਧਨ ਚਾਰਜ ਆ ਜਾਂਦਾ ਹੈ ਅਤੇ ਸਵੀਕਾਰੀ ਰਿਣ ਚਾਰਜ ਹਾਸਲ ਕਰ ਲੈਂਦਾ ਹੈ, ਜਿਵੇਂ :––
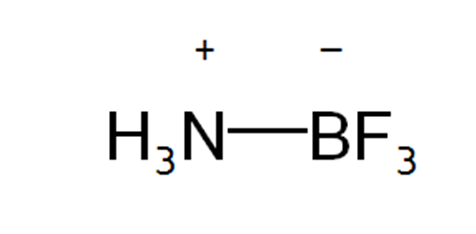
ਹ. ਪੁ.––ਐਨ. ਬ੍ਰਿ. 22 : 944; ਆ. ਕੈ.––ਫ਼ਿਨਾਰ 1 : 13.
ਲੇਖਕ : ਭਾਸ਼ਾ ਵਿਭਾਗ,
ਸਰੋਤ : ਪੰਜਾਬੀ ਵਿਸ਼ਵ ਕੋਸ਼–ਜਿਲਦ ਚੌਥੀ, ਭਾਸ਼ਾ ਵਿਭਾਗ ਪੰਜਾਬ, ਹੁਣ ਤੱਕ ਵੇਖਿਆ ਗਿਆ : 2433, ਪੰਜਾਬੀ ਪੀਡੀਆ ਤੇ ਪ੍ਰਕਾਸ਼ਤ ਮਿਤੀ : 2015-09-03, ਹਵਾਲੇ/ਟਿੱਪਣੀਆਂ: no
ਵਿਚਾਰ / ਸੁਝਾਅ
Please Login First